投稿范圍:煤化工、鹽化工、生物化工、醫藥化工、石油化工、農用化工、化工環保、工業水處理、精細化工、日用化工、燃氣化工、橡膠與輪胎工業、化肥農藥、有機與無機、涂料與油墨、染料與顏料、助劑與添加劑、樹脂與塑料、膠粘劑、化工教育、化工設計、化工機械與裝備
近日,國家納米科學中心研究員楊延蓮、項目研究員朱凌與中國醫學科學院基礎醫學研究所研究員余佳合作,在基于工程化細胞外囊泡藥物遞送體系的腫瘤N6-甲基腺嘌呤核苷酸甲基化(m6A)表觀遺傳調控與免疫療法方面獲新進展。相關研究成果以m6A Reader YTHDF1-targeting Engineered Small Extracellular Vesicles for Gastric Cancer Therapy Via Epigenetic and Immune Regulation為題,發表在《先進材料》(Advanced Materials)上。
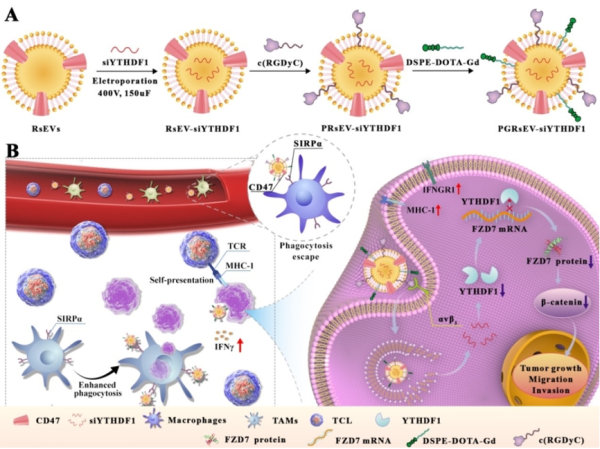
m6A是存在于真核生物中最普遍的RNA轉錄后修飾,參與DNA修復、細胞分化及細胞周期凋亡等基本生命活動,在腫瘤起因和發展中有重要作用。RNA甲基化含量和甲基化RNA的穩定性、代謝、表達、生物功能由甲基轉移酶、脫甲基酶及m6A閱讀蛋白動態調節。研究表明,m6A 甲基化閱讀蛋白YTH N6甲基腺苷RNA結合蛋白1(YTHDF1)在胃癌組織中過表達,且與胃癌的發生、進展及遠端轉移相關。因此,靶向YTHDF1并進行m6A的表觀遺傳調控有望實現對胃癌的抑制和治療。靶向YTHDF1進行RNA干擾是有效的策略,然而盡管胃癌組織YTHDF1高表達,但正常組織中YTHDF1也廣泛分布,所以m6A表觀遺傳調控存在特異性差、具系統毒性和免疫原性等問題,限制了該方法的臨床應用。此外,核酸藥物的遞送效率也是亟需解決的問題。
針對核酸藥物遞送問題和胃癌組織靶向問題,科研團隊構建了基于細胞外囊泡的工程化納米藥物遞送體系,通過靶向和調控m6A表觀遺傳調控因子用于胃癌的治療。細胞外囊泡是細胞產生的具磷脂雙分子層結構的囊泡結構,具有良好的生物相容性、低免疫原性和低毒性,被認為是藥物遞送的理想納米載體。工程化修飾后的細胞外囊泡可靶向遞送敲降YTHDF1表達的siRNA,并以m6A依賴的方式抑制Wnt通路受體卷曲蛋白FZD7的翻譯,致使Wnt/β-catenin通路失活,進而抑制胃癌細胞的增殖和發生進展。同時,科研團隊發現腫瘤細胞的YTHDF1降低后,可介導干擾素(IFN)-γ受體1 (IFNGR1)的過表達,增強IFN-γ效應,促進腫瘤細胞主要組織相容性復合體I(MHC-I)的表達,使免疫原性腫瘤細胞直接實現自呈遞,有效激活細胞免疫反應。通過表觀遺傳調控和免疫調節相互作用抑制胃癌的發展和轉移,為胃癌治療提供新策略。
研究工作得到中科院戰略性先導科技專項、國家重點研發計劃和國家自然科學基金的支持。